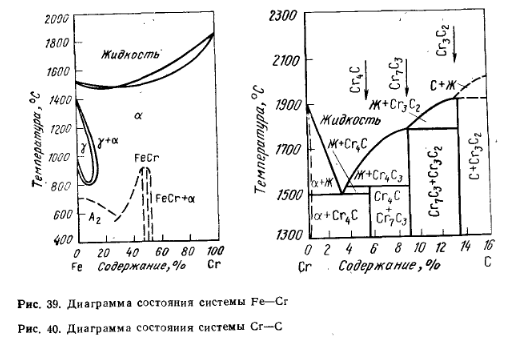
Хром (от греческого слова chroma — цвет) переходный элемент VI группы периодической системы элементов Д. И. Менделеева, имеет электронную структуру 1s22s22р63s23р63d54s1. Твердость по минералогической шкале 8,5. Это серебристо-белый блестящий металл, обладающий следующими физико-химическими свойствами: атомная масса 52,01; валентность 1—6; плотность 719 г/см3; температура плавления 1855°С, кипения 2469°С. С железом хром обладает полной взаимной растворимостью в твердом и жидком состоянии (рис. 39) Температура плавления высокоуглеродистого феррохрома ~1500°С и низкоуглеродистого 1600—1630 °С. С углеродом хром образует прочные карбиды Cr23С6 (5,7 % С), Cr7С3 (9,01 % С) и Cr3С2 (13,34 % С), имеющие температуру плавления 1520, 1780 и 1890 °С соответственно. Диаграмма состояния системы Cr — С приведена на рис. 40. В системе Cr—Fe—С существуют двойные карбиды: (Cr, Fe)23C6; (Cr, Fe)7C3; (Cr, Fe)3C2.
Высокоуглеродистый феррохром имеет в своем составе углерод в основном в виде (Cr, Fe)7C3, а рафинированный содержит углерод в виде (Cr, Fe)23C3. С кремнием хром образует ряд силицидов: Cr3Si (15,25% Si); Cr5Si3 (24,45 % Si); CrSi (35,05 % Si); CrSi2 (51,9% Si), имеющие температуры плавления 1710, 1597, 1545 и 1550 С соответственно. Строение и свойства жидких сплавов хрома с кремнием рассмотрены П. В. Гельдом. В тройной системе Fe—Cr—Si при 15 и 25 % Fe в сплаве обнаруживаются силициды (Cr, Fe) Si и (Cr, Fe) Si2. Первый сплав с 32—35 % Si плавится при 1500 °С, второй с 52 % Si плавится при 1350—1400 °С. Ферросиликохром с 60 % Si состоит из кремния и (Fe, Cr)Si2; с 50 % Si — из (Fe, Cr) Si2; с 40% Si — из (Fe, Cr)Si2 и (Fe, Cr) Si; С 30% Si— из (Fe, Cr) Sі и (Fe, Cr)3Si2; С 20% Sі — из (Fe, Cr)3Si2 н α-раствора. При взаимодействии силицидов с углеродом могут образовываться тройные фазы MemSinCp. Силициды хрома прочнее его карбидов, поэтому в сплавах Fe—Cr—Si при увеличении содержания кремния понижается содержание углерода (рис. 41). 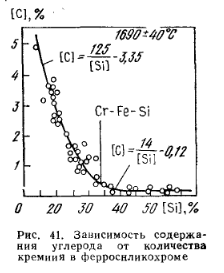 С кислородом хром образует ряд оксидов (табл. 63). Наиболее прочным является оксид Cr2O3, в виде которого хром в основном находится в рудах и шлаках. В кислых шлаках встречается и CrO, особенно при восстановительных процессах. В высокоизвестковых шлаках при окислительных процессах частично образуется CrO3. Хром с серой образует сульфиды CrS, Cr2Sз и CrзS4. С фосфором хром образует фосфиды Cr3P, Cr2P, CrP И CrP2. С азотом хром образует прочные соединения нитриды Cr2N И CrN. С повышением температуры термодинамическая прочность нитридов снижается. Температура плавления Cr2N ~ 1700 °С, CrN диссоциирует при 1500 °С, плотность их соответственно равна 6,5 и 6,18 г/см3. Растворимость азота в жидком хроме составляет 4,2 % N при 1898 °С и 6,5 % N для переохлажденного расплава при 1600 °С. Растворение азота в хроме значительно понижает температуру его плавления. Твердый хром, насыщенный азотом при 800—1000°С может содержать его до 21 %.
С кислородом хром образует ряд оксидов (табл. 63). Наиболее прочным является оксид Cr2O3, в виде которого хром в основном находится в рудах и шлаках. В кислых шлаках встречается и CrO, особенно при восстановительных процессах. В высокоизвестковых шлаках при окислительных процессах частично образуется CrO3. Хром с серой образует сульфиды CrS, Cr2Sз и CrзS4. С фосфором хром образует фосфиды Cr3P, Cr2P, CrP И CrP2. С азотом хром образует прочные соединения нитриды Cr2N И CrN. С повышением температуры термодинамическая прочность нитридов снижается. Температура плавления Cr2N ~ 1700 °С, CrN диссоциирует при 1500 °С, плотность их соответственно равна 6,5 и 6,18 г/см3. Растворимость азота в жидком хроме составляет 4,2 % N при 1898 °С и 6,5 % N для переохлажденного расплава при 1600 °С. Растворение азота в хроме значительно понижает температуру его плавления. Твердый хром, насыщенный азотом при 800—1000°С может содержать его до 21 %.


