Абсолютно все вещества состоят из атомов, но в большинстве случаев они не просто плавают по отдельности, а образуют определенные связи. Основное их предназначение заключается в достижении наиболее стабильного состояния. Все системы стремятся к равновесию – основной закон Вселенной. В химии и физике он имеет большое значение и характеризует многие процессы, происходящие на молекулярном уровне.
Атомная связь может быть разных типов и иметь разные свойства. Одним из примеров можно считать такие два элемента, как графит и алмаз. Они оба являются углеродом, но из-за природы их химического взаимоотношения, они демонстрируют абсолютно разные характеристики материала.
Типы химических связей

Изучение атомных соединений – довольно необходимая задача, с помощью которой можно решить вопрос по поводу того, как атомы взаимодействуют друг с другом, и к чему это приводит. Знания часто используются в металлургии, химической промышленности, медицине и др. Ведь, чем прочнее атомная связь, тем выше напряжение, необходимое для увеличения пространства между атомами и, следовательно, тем больше модуль упругости.
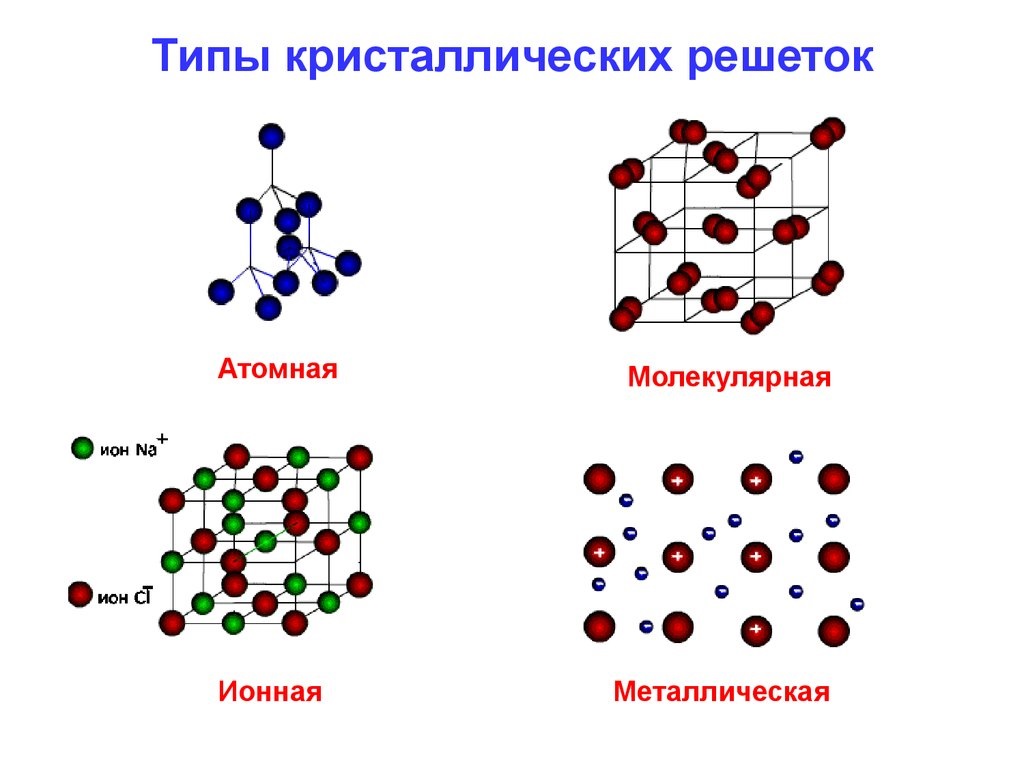
Сейчас известно шесть типов атомных связей: металлическая, ковалентная, ионная, водородная, двухэлектронная трехцентровая, Ван-дер-Вальса. Но наиболее распространенными являются:
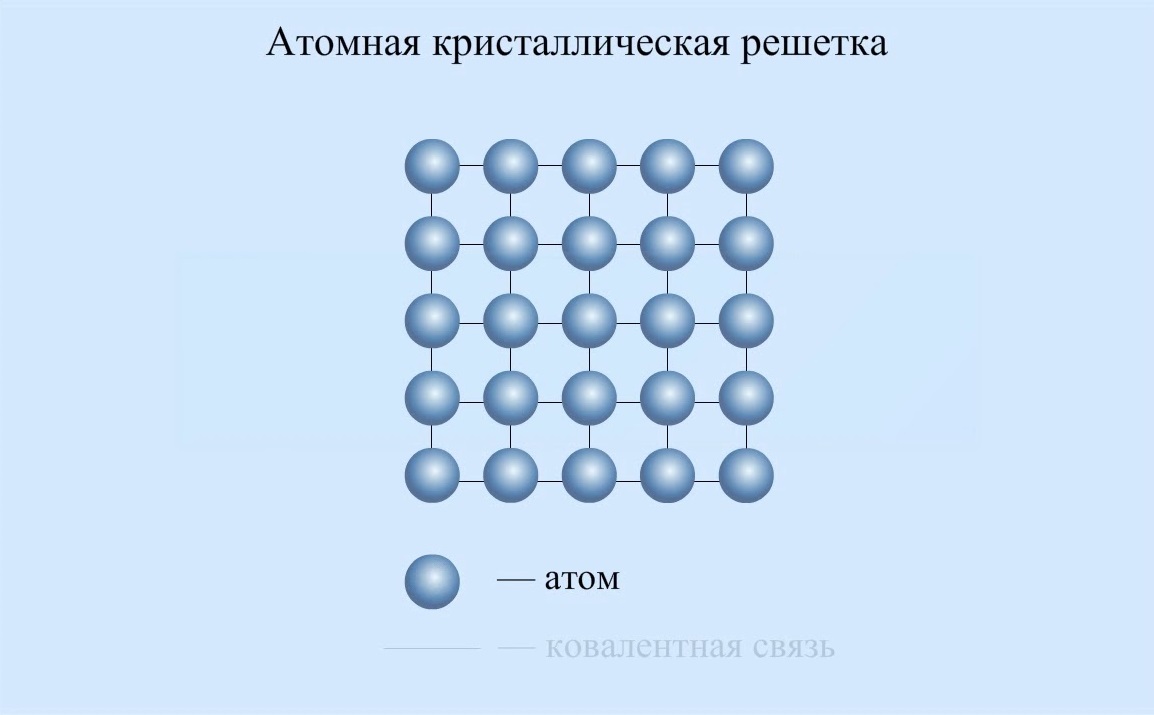
- ковалентная – образуется, когда валентные электроны одного атома распределяются между двумя или более конкретными атомами. Она может быть полярной и неполярной. Ковалентные обычно встречаются в органических молекулах на основе углерода. Многие полимеры имеют именно этот тип. Примером ковалентной связи можно считать образование молекул воды;
- металлическая атомная связь – это та, которая образуется, когда валентные электроны не связаны с конкретным атомом или ионом, а существуют в виде своеобразного «облака» электронов вокруг ионных центров;
- ионная. Она образуется в том случае, когда валентные электроны переносятся от одной частицы к другой, образуя внешнюю электронную оболочку. Связь образуется между ионами с противоположными зарядами. Типичным примером можно считать соль. Вообще, ионные материалы обладают высокой хрупкостью, хотя между двумя ионами существуют довольно сильные силы.
Особенности атомных связей
Прочность видов связей между двумя атомами увеличивается по мере увеличения количества электронных пар. Но, кроме видов, существуют разные их типы: первичные и вторичные. Первичные образуют химические взаимоотношения, которые и удерживают частицы вместе. Вторичные же считаются более слабыми элементами. К вторичным можно отнести водородные и Ван-дер-Вальса.
Существует три разных способа, которыми внешние электроны могут образовывать связь:
- электроны можно переносить от одной частицы к другой;
- электроны могут быть разделены между соседними атомами;
- могут использоваться всеми атомами в материале.
К чему приводят способы, можно проследить на примере атомной связи натрия. Атом имеет всего один электрон на внешней орбите, но он отдает его другому, чтобы заполнить дыру в хлоридной оболочке, используя первый способ. Как только это происходит, у атома натрия будет отсутствовать один электрон. По этой причине он будет иметь положительный заряд и станет ионом натрия.
Одновременно атом хлора, который получил лишний электрон, приобретет отрицательный заряд и станет ионом хлора. Электрическая сила между этими противоположно заряженными элементами будет притягиваться, связывая их вместе. Полученное соединение будет представлять собой твёрдые кубические кристаллы, которые также известны как обычная поваренная соль.
Теперь вы знаете, какие вообще существуют типы связей атомов, а также основные способы их образования.