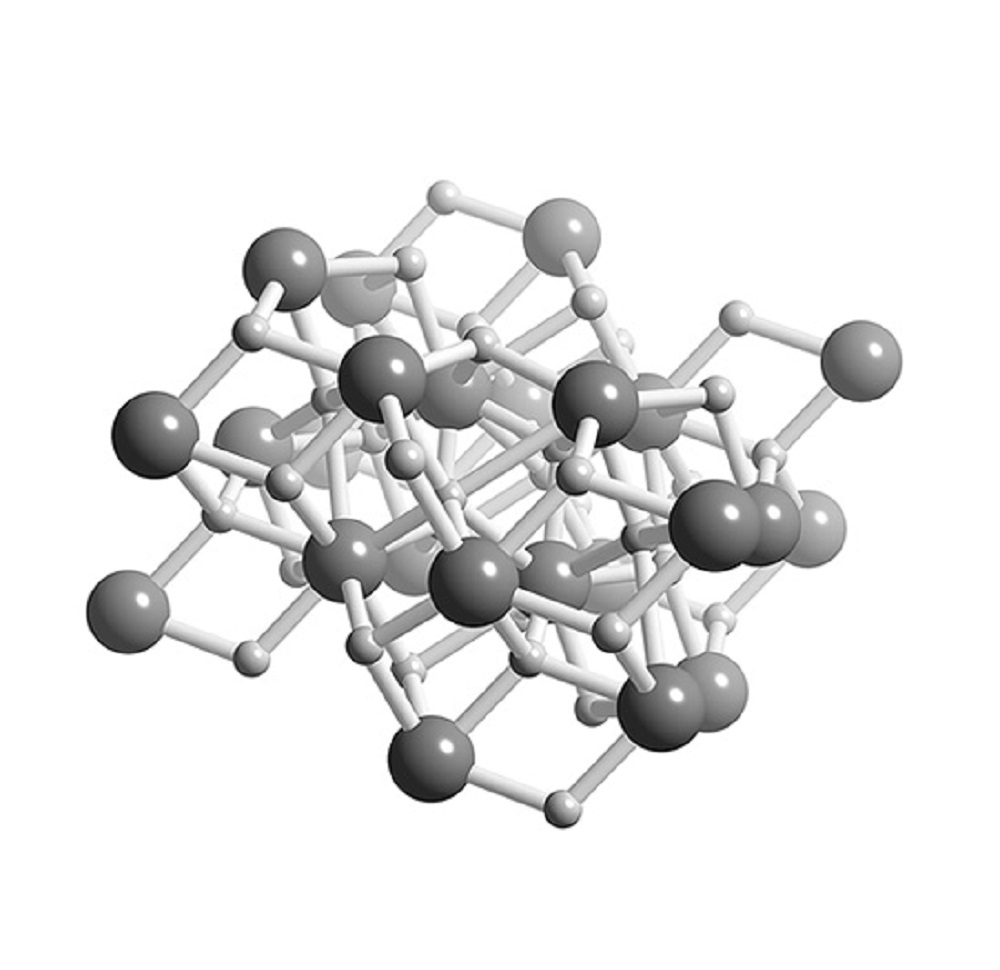
Гидрид кальция — это не вода, а сложное, неорганическое, бинарное соединение, в котором в молекуле соединились атомы кальция и водорода. Формула записывается так: СаН2. Вещество относится к группе солевые гидриды.
Кратко о его свойствах и области применения
Гидрид кальция является кристаллическим веществом белого цвета, но за счет примесей получает серый оттенок. Температура его плавления с разложением — 816 градусов. Проявляет высокую чувствительность к кислороду воздуха, в качестве сильного восстановителя вступает в реакцию с водой и кислотами:
- при взаимодействии с водой образует гидроокись кальция и водород СаН2 + 2Н2О → Са(ОН)2 + 2Н2;
- при взаимодействии с кислотами, например, с соляной, образует хлорид кальция и водород: СаН2 + 2НСl → СаСl2 + 2Н2.
Также активно поддается взаимодействию с кислородом, давая в итоге окись кальция и воду. А отдельным важным свойством является способность восстанавливать окиси многих металлов до чистого металла, например, в случае с титаном реакция такая: 2СаН2 + TiО2 → CaO + Ti + 2Н2.
Получение гидрида кальция позволило человечеству найти удобный вариант добычи твёрдого водорода (как видно из описанных выше реакций, все они приводят к выделению Н2). Несмотря на то, что такой способ получения водорода недешёвый, всё же он активно используется для наполнения аэростатов, воздушных шаров, метеорологических зондов. Также данное вещество широко применяется как осушитель органических жидкостей и смазочных масел, нашёл активное лабораторное использование. Отдельно стоит подчеркнуть тот факт, что вопросы того, как рационально получить гидрид кальция, актуальны для металлургии, так как он способен помогать в восстановлении тугоплавких металлов из их окисей металлотермическими способами.
Магниетермия и кальциетермия
Магниетермия и кальциетермия — это процессы, протекающие с выделением теплоты и направленные на реакции восстановления металлов из их соединений за счет задействования более химически активных металлов. Это суть, объединяющая процессы. Отличаются же они по источнику восстановления, например:
- магниетермия;
- кальциетермия;
- алюминотермия и другие.
Магниетермия и кальциетермия — это экзотермические процессы, благодаря которым получается восстановить металлы из оксидов и галогенидных солей. Магнием лучше всего восстанавливаются фториды и хлориды, этот восстановитель нашел широкое применение в особенности при производстве титана и тугоплавких металлов. В частности, магниетермическое восстановление тетрахлорида титана дает возможность создания целого промышленного предприятия с разными технологическими этапами и замкнутым циклом, в ходе которого промежуточно получается хлорид магния, а затем электролизом раскладывается на магний и хлор. Кальциетермия стала наиболее ценной находкой для производства урана.