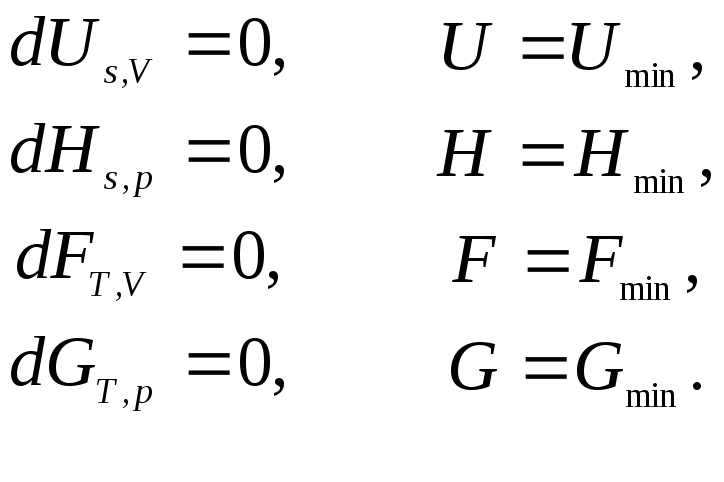Вокруг нас происходят уникальные и удивительные химические процессы, о которых стоит поговорить. Одним из таких является термодинамическое равновесие. Это процесс, при котором состояние системы не имеет тенденции к самопроизвольному изменению. Это можно сделать исключительно путем внешнего изменения одной из функций состояния. Для термодинамической равновесной системы с данной энергией энтропия, то есть мера хаоса, больше, чем у любого другого состояния с идентичной энергией.
Учеными было замечено, что некоторые свойства объекта, такие как давление в объеме газа, длина металлического стержня или электрическая проводимость металла, могут изменяться при повышении или понижении температуры. Когда изменение этих свойств прекращается, считается, что состояние объектов – это термодинамическое или тепловое равновесие.
Требования для термодинамического равновесия

По факту, равновесие описывает состояние исчезающих движущих сил или градиентов в то время, когда все остается как есть. Для достижения термодинамического равновесия есть определённые условия: все интенсивные (температура, давление) и экстенсивные показатели должны быть стабильными (постоянными). Следовательно, любое из этих свойств должно быть равно нулю.
Вот основные требования:
- температура всех частей системы должна быть одинаковой;
- не должно быть суммарных несбалансированных сил в части или в целой системе;
- не должно быть изменений химической реакции.
Чтобы система была в равновесии, необходимо, чтобы механическое, тепловое и химическое состояние было стабильным. В том случае, если любое из вышеперечисленных условий не выполняется, считается, что система находится в неравновесном состоянии.
Как протекают реакции с учетом термодинамического равновесия?

Когда вы узнали о термодинамическом условии химического равновесия, механического и теплового, можно легко применять знания на практике. Для многих специалистов важно условие стабильности для проведения опытов, так как это позволяет двум разным элементам взаимодействовать, обмениваясь свойствами.
Одним из примеров можно считать реакцию гидрата поваренной соли для термических применений. В ней учитываются такие параметры, как теоретический коэффициент полезного действия, плотность хранения и температура стабильности. Реакцию гидратации, при которой все исходные вещества и продукты остаются твердыми, можно обрабатывать аналогично адсорбционным системам.
Учитывая термодинамические условия равновесия в термодинамике, можно обеспечить высокую энтальпию реакции. Для этого важно использовать уравнение Клапейрона. С помощью него можно рассчитать равновесное давление пара каждой реакции гидратации как функцию температуры, используя энтальпию реакции и свободную энергию Гиббса. Таким образом можно добиться теплового равновесия испарения или конденсации.
Критерии изменения термодинамического равновесия
Состояние устойчивости предусматривает собой сохранение текущего состояния. Оно может быть изменено только в случае воздействия на другие системы. Если две разные системы соприкасаются в физическом контакте, их свойства изменяются. То же самое происходит, если увеличить температуру. В отдельных случаях могут произойти изменения в самих фазах.

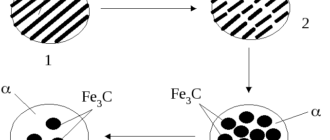
Как мы уже поняли, термическое равновесие системы можно легко изменить. Но можно ли изменить само состояние объекта? Да. Для металла этот процесс называется рекристаллизацией. Он предусматривает собой не только образование, но и рост кристаллических зерен поликристалла за счет других.
Теперь вы узнали о данном процессе, а также о том, какие необходимо соблюдать условия, чтобы его добиться.