В таблице Менделеева серебро фигурирует под латинским названием «аргентум», поскольку именно Аргентина открыла испанским колонизаторам огромные залежи этого драгоценного металла. Рассмотрим взаимодействие серебра с кислородом и другими веществами, определяющими свойства материала.
Свойства серебра
Изделия из серого или серебристо-белого металла давно вошли в обиход в виде столовых приборов, посуды, ювелирных украшений и предметов культа. Благородный металл имеет гранецентрированную кубическую кристаллическую решетку. Его температура плавления — 961℃, кипения — 2210℃. Материал плотностью 10,5 г на квадратный сантиметр пластичный, хорошо поддается обработке:
- скручиванию;
- ковке;
- прокату;
- гравировке;
- резке;
- полировке;
- алмазной огранке;
- изгибанию и прочим видам металлообработки.
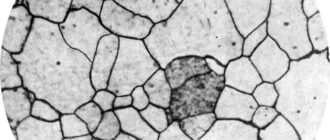
Серебро тверже золота и тяжелее меди. Что касается химических свойств, то металл считается инертным, малоактивным, не растворяющим в себе кислород. Образование на нем темного налета — сульфида серебра, обусловлено, прежде всего, реакцией с частицами серы, представленными в воздухе сероводородным соединением. В составе других химических элементов серебро преимущественно одновалентное.
Ископаемый металл получают из глинистых сланцев, частично добывается в виде самородков. На некоторых месторождениях золота содержание серебра в драгметалле достигает 50%, поэтому его можно расплавить в печи и получить два вида дорогостоящих материалов. В чистом виде серебро практически не используется, чаще всего оно входит в состав сплавов, используемых преимущественно для изготовления ювелирных изделий. В отличие от золота белый металл не растворяется в «царской водке» — смеси концентрированных кислот — азотной и соляной.

Кислород и серебро
Окисление серебра кислородом в обычных условиях не происходит. Во влажной среде происходит медленная реакция металла с кислородом и сероводородом: 4Аg + 2Н2S + О2, получая на выходе соединение 2Аg2S + 2Н2О. Наиболее устойчивой степенью окисления металла является значение +1, его оксидом является Ag2O — темно-коричневое вещество, не реагирующее на воду, но при взаимодействии с кислотами образующее соли, например, соединение Аg2О + 2НСlО4 дает на выходе 2АgСlО4 + Н2О. Водная суспензия оксида серебра способна поглощать углекислый газ, присутствующий в воздухе.
При меньшей степени окисления (+1), серебро проявляет в химсоединениях большую устойчивость. При нормальных температурах и давлении металл инертен не только к кислороду, но и к:
- кремнию;
- водороду;
- углероду;
- азоту.
Получить тонкую пленку, всего 12 нм толщиной можно при обработке плазмой кислорода, озоном, облучая металл ультрафиолетом. Растворить кислород можно только в расплавленном серебре в объеме 20 к 1. После застывания сплава почти весь кислород вытесняется из слитка. Период остывания такой заготовки очень зрелищный, сопровождается разбрызгиванием металла, но при резком охлаждении возможна детонация.