Окислительная способность шлака
Процесс перехода кислорода из шлака в металл описывается уравнением
(FeO) = [Fe] + [О]. (45)
Концентрация железа в металле равна единице, тогда константа равновесия реакции (45) определяется выражением
KFeO = [O,%]/(аFeO). (46)
В шлаке железо находится в виде двух- и трехвалентного, т. е. если исходить из молекулярного строения шлака, то в виде FeO и Fe2O3. При анализе окислительной способности шлака в большинстве случаев принято все железо в шлаке пересчитывать на двухвалентное, т. е. на FeO:
(FeO) = (FeO´) + 1,35 (Fe2O3), (47)
где (FeO´), (Fe2O3) — содержание в шлаке соответственно FeO и Fe2O3.
Содержание и активность FeO связаны соотношением
aFeO = fFeO (FeO), (48)
где fFeO— коэффициент активности FeO.
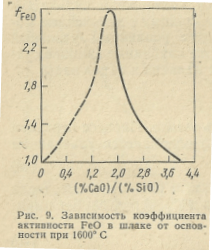
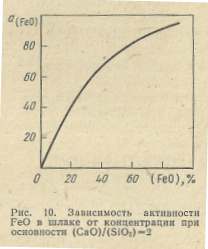
Для сталеплавильных шлаков коэффициент активности FeO зависит главным образом от температуры и основности шлака. На рис. 9 приведена зависимость коэффициента активности FeO от основности шлака при 1600° С. Как видно, коэффициент активности FeO в сильно основных и кислых шлаках различается незначительно. При одной и той же основности шлака и постоянной температуре при содержании до 25% FeO значение fFeO остается постоянным и, следовательно, активность FeO становится пропорциональна его концентрации (рис. 10). При дальнейшем повышении содержания FeO в шлаке увеличение его активности происходит в меньшей степени, чем концентрации.
Десульфурирующая и дефосфорирующая способность шлака
В молекулярной форме реакция удаления серы из металла (десульфурация) в основной шлак опишется уравнением
[FeS] +(CaO) = (CaS) + (FeO),
а константа равновесия
![]()
Десульфурирующая способность шлака обычно оценивается коэффициентом распределения серы
Ls = (%S)/[%S]. (51)
Коэффициент распределения серы Ls прямо пропорционален отношению (aCaS)/[aFe]. Из выражения (51) следует
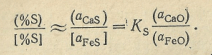
Десульфурирующая способность шлака возрастает с повышением активности CaO и уменьшением активности FeO. Между активностями СаО и FeO, с одной стороны, и их содержанием, с другой, существует прямо пропорциональная зависимость. Поэтому повышение содержания CaO в шлаке и уменьшение концентрации в нем FeO способствуют улучшению десульфурации металла, переходу серы из металла в шлак.
 Однако следует иметь в виду, что десульфурация заметно улучшается при уменьшении содержания FeO в шлаке только с 10 до 0,5%. При содержании в шлаке 10—20% FeO десульфурирующая способность шлака остается неизменной, а при более высоком содержании иногда даже наблюдается улучшение десульфурации металла. Подобное явление объясняется тем, что при повышенном содержании FeO в шлаке часть серы связывается в виде сульфида железа FeS.
Однако следует иметь в виду, что десульфурация заметно улучшается при уменьшении содержания FeO в шлаке только с 10 до 0,5%. При содержании в шлаке 10—20% FeO десульфурирующая способность шлака остается неизменной, а при более высоком содержании иногда даже наблюдается улучшение десульфурации металла. Подобное явление объясняется тем, что при повышенном содержании FeO в шлаке часть серы связывается в виде сульфида железа FeS.
Под основными шлаками окисление фосфора (дефосфорация) происходит по следующей реакции:
4 [Р] + 5 (FeO) + 4 (CaO) = (4CaO·P2O5) + 5[Fe]. (53)
Поскольку (%P2O5)=0,18 (%4CaO·P2O5), а концентрация железа в металле равна примерно единице, т. е. [Fe]≈1, то постоянную равновесия реакции (53) через концентрацию компонентов можно записать
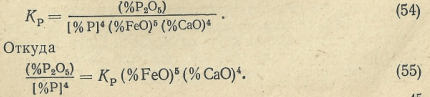
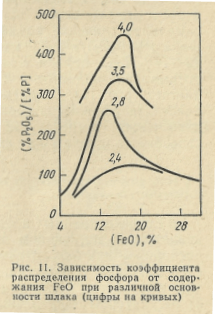
Для обеспечения дефосфорации металла, согласно выражению (55), необходимо иметь в шлаке повышенное содержание СаО и FeO. Однако при высоком содержании CaO в шлаке образуются ферриты кальция (CaO·Fe2O3), что уменьшает долю CaO, способного взаимодействовать с P2O5. Поэтому, как показывают опыты, для обеспечения максимальной дефосфорации металла необходимо иметь определенное соотношение FeO и СаО и значение основности шлака (% СаО)/(% SiO2). Максимальное значение коэффициента распределения фосфора (% P2O5) / [ % P] наблюдается при содержании 12—17% FeO, причем с повышением основности шлака оптимальное значение содержания FeO несколько возрастает (рис. 11). Согласно данным ряда исследований, константа равновесия реакции (53) Кр уменьшается с повышением температуры; поэтому дефосфорирующая способность шлака выше при пониженных температурах.


