История благородных металлов
Благородные металлы отличаются от других элементов, известных еще древним народам, неизменяемостью на воздухе, трудностью добычи и высокой стоимостью. Теперь их также называют драгоценными; хотя некоторые тугоплавкие элементы пока дороже золота и платины.
Золото и серебро были известны задолго до начала нашей эры. Египтяне разрабатывали золотоносные россыпи в Нубии (Восточная Африка). Финикийцы там же открыли богатую золотом страну Офир, они знали о многих месторождениях золота и серебра в Армении, Испании и на Кипре.
Первые достоверные сведения о древней металлургии благородных металлов имеют давность, соизмеримую с историей древней Греции — 40–50 вв. до н. э.
Первым применением золота (Au) и серебра (Ag) было изготовление украшений и утвари, а с развитием обмена – монеты. До конца прошлого века, а кое-где и поныне, эти металлы во многих странах служили денежным материалом, а затем приобрели функцию фондового эквивалента банкнот.
В 1738 г. испанский математик Дон Антоние де Уллоа во время путешествия в Южную Америку обнаружил платину (Pt) – «белое золото», считавшуюся сначала сплавом золота и серебра. В литературе XVIII в. ее называли «гнилым» или «лягушечьим» золотом, ценили в два раза ниже серебра и иногда для фальсификации добавляли в золотую монету. Только в 1752 г., после исследований Шеффера, платина была признана новым элементом.
В 1803 г. Волластон, обрабатывая самородную платину царской водкой, обнаружил в растворе два других благородных металла – палладий (Pd) и родий (Rh). Вскоре (1803 – 1804 гг.) Смитсон Теннант в нерастворимом остатке от подобной обработки платины нашел осмий (Os) и иридий (Ir). Рутений (Ru) открыл в 1844 г. К. К. Клаус в уральских месторождениях платины и назвал его в честь России Rhutenia (лат.).
Интересно отметить происхождение названий других платиноидов: платина соответствует испанскому plata – серебро, родий – греческому родос, отмечающему розовый цвет растворов. Палладий назван в честь открытия астероида Паллада, а иридий происходит от греческого ирис, принятого из-за различия окраски ионов.
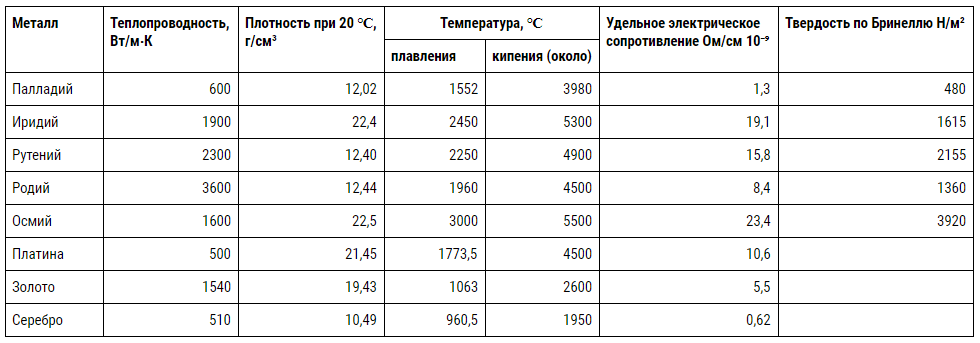
Некоторые физические и механические свойства платиноидов собраны в табл. 23, знакомясь с которой следует обратить внимание на высокие температуры плавления металлов и их твердость, близкую, например, у иридия, осмия и рутения к закаленной стали. Вместе с тем золоту и платине свойственны мягкость, ковкость и тягучесть. О химических свойствах сказано ниже.
С развитием промышленности благородные металлы находили все более широкое техническое применение.
Современное значение благородных металлов
Золото, продолжая оставаться денежным эквивалентом, входит во многие сплавы с серебром, платиной, медью, никелем, оловом, в том числе применяемые за рубежом при монтаже реактивных двигателей, ракет и ядерных реакторов. Чистый металл с его высокой отражательной способностью и коррозионной стойкостью может служить прекрасным покрытием, хорошо отражающим свет. Известно, что первые американские спутники покрывали слоем золота толщиной в несколько тысячных или сотых долей микрометра. Использование металла для зубных протезов постепенно сокращается: для этого разработано несколько заменяющих сплавов; однако они пока еще остаются менее привлекательными.
Серебро вошло в область промышленного использования после изобретения фотографии, а далее также в связи с широким распространением кинематографии, рентгенографии, производства щелочных аккумуляторов и ядерной энергии. Спрос промышленности на него давно уже превышает выплавку, и этот дефицит стараются пополнять вторичными металлами, перерабатывая старую монету, зеркальный бой, ювелирные изделия и использованные фото-киноматериалы.
Платину долго не умели очищать от примесей, понижающих ее ковкость. В 70-х годах XVIII в. впервые были получены технические изделия из чистого металла: пластины, тигли, проволока; они ценились из-за стойкости против концентрированных сильных кислот. В начале XIX в. стали делать платиновые сосуды для получения серной кислоты массой более 10 кг. Вместе с тем до середины того же столетия в некоторых странах из платины чеканили монету и делали украшения. После второй мировой войны потребление ее в ювелирном деле и медицине, составлявшее ранее около 60 % общего производства, сократилось до 8–10 %. Наряду с этим сильно возрос спрос на платиноиды, как на заменители платины. В виде сетки, губки, проволоки, жести и в мелко раздробленном состоянии платина, палладий и сплавы платины с палладием, родием, иридием, рутением, а также сплавы платины и палладия с неблагородными металлами служат катализаторами в неорганической и органической технологии. Их применяют при синтезе аммиака из азота и водорода, для гидрогенизации и дегидрогенизации органических веществ, восстановления нитросоединений и галогенидов, в производстве серной и синильной кислот.
В нефтяной промышленности катализаторы из платиновых металлов необходимы для производства высокооктанового топлива и ряда синтетических продуктов. При гидрировании некоторых органических соединений применяют осмий. Палладий служит также для очистки водорода и дейтерия.
В электротехнике, электронике и приборостроении платина, платиноиды и разные их сплавы употребляются при монтаже аппаратуры связи, для деталей астрономических приборов и электродов рентгеновских трубок. Термопары из платины и ее сплавов с родием пригодны для длительного измерения высоких температур; возможные пределы этого расширяются с увеличением процента родия в сплавах, который менее летуч. Покрытия родием, имеющим высокую отражательную способность, важны для прожекторной техники, они не теряют свойств до 400 °С. Весьма твердые сплавы осмия с иридием идут на изготовление точных измерительных инструментов – астрономических и мореходных. Замена платины платиноидами часто выгодна: палладий и рутений дешевле платины.
Иридий приблизительно в пять раз дороже золота; поэтому применение его в чистом виде пока мало. Тигли из этого металла пригодны для опытов при температурах до 2300 °С. Весьма стойки электролитические и химические покрытия иридием металлов и керамики толщиной менее 0,1 мм. Радиоактивный изотоп Ir192 с периодом полураспада 74,5 суток, получаемый в атомных реакторах, служит для гамма-дефектоскопии и датчиком уровня сыпучих материалов.
Осмий также очень дорог – по крайней мере, в 30 раз дороже золота. В некоторых реакциях гидронизации органических веществ он оказывает более сильное каталитическое действие, чем платина. Несмотря на высокую стоимость, из соединений осмия делают особую черную краску для росписи фарфора.
Свойства благородных металлов
Несмотря на разнообразие свойств, благородные металлы обнаруживают и некоторое сходство. Прежде всего все они переходные элементы V и VI периодов, где расположены последовательными рядами с №44 по 47 и с №76 по 79. По размещению в группах Периодической системы рутений и осмий сходны с железом, палладий и платина – с никелем, родий и иридий – с кобальтом, а золото и серебро – с медью.
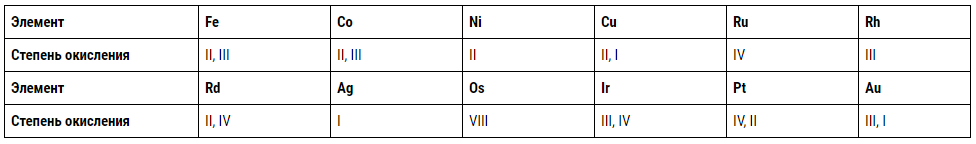
Структура атомов переходных элементов различается зарядом ядра, числом d-электронов и внешних s-электронов. Последние имеют сравнительно малое значение из-за преимущественного образования благородными металлами комплексных соединений и малого числа простых солей. По мере заполнения d-орбиталей наиболее типичная степень окисления, показанная ниже римскими цифрами, понижается, а с увеличением порядкового номера в группах она возрастает:
Осмий окисляется кислородом воздуха при обычных температурах до OsO4, а иридий, рутений и палладий только в тонко диспергированном виде и достаточно быстро лишь при нагревании.
Другие благородные металлы не окисляются даже чистым кислородом. Оксиды: Ag2O, Au2O3, Rh2O3, Ir2O3, PtO2 и др. можно получить только косвенным путем — преобразованием иных химических соединений этих элементов.
Серебро и палладий растворяются в азотной кислоте. Золото и платина окисляются царской водкой, которая на иридий, родий и рутений действует лишь весьма медленно, палладий она также переводит в раствор, а серебро – в твердый хлорид. На осмий и рутений царская водка совсем не действует.
Родий окисляется концентрированной, горячей серной кислотой, образуя сульфат Rh2(SO4)3, он также реагирует с расплавами кислых сульфатов натрия и калия.
Осмии и рутений переводят в растворы сплавлением с оксидами натрия (II) либо бария (IV) (Na2O2, BaO2) или плавкой со щелочью и окислителем, например, с NaOH и NaClO3. Сплавы или спеки растворяются в воде.
Рутений(II), родий (III) и палладий (II) образуют простые ионы только в растворах перхлоратов, а серебро также в растворах сульфатов, нитратов, ацетатов и некоторых других. Прочие благородные металлы образуют в водных растворах лишь комплексные катионы и анионы, окислительно-восстановительные свойства которых в значительной мере зависят от прочности связи с лигандом. Часто встречаемые в литературе потенциалы простых ионов благородных металлов получены расчетом и не всегда имеют реальный физический смысл; хотя и могут быть использованы в качестве термодинамических констант.
