Свойства бериллия
Порядковый номер бериллия 4, его атомная масса 9,013. Бериллий относится ко II группе периодической системы Д.И. Менделеева. Это металл серого цвета, по внешнему виду напоминающий сталь.
Бериллий плавится при температуре 1287 ºС и кипит при 2450 ºС. У него обнаружены две полиморфные модификации с температурой аллотропического превращения 1254 ºС. Низкотемпературная модификация бериллия (α-Be) при 18 ºС имеет гексагональную решетку с параметрами а = 0,22856 нм, с = 0,35832 нм, с/а = 1,5677. Высокотемпературная β-модификация образует объемноцентрированную кубическую решетку с периодом 0,2549 нм при 1254 ºС. Межатомное расстояние при полиморфном превращении α→β уменьшается, а плотность возрастает примерно на 5 %.
У бериллия очень небольшой атомный диаметр – 0,226 нм. Плотность при 20 ºС составляет 0,848 г/см3, что лишь незначительно больше плотности самого легкого конструкционного материала – магния. Бериллий отличается очень высокой скрытой теплотой плавления, равной примерно 1625 Дж/г. Для расплавления стали нужно в 3,3 раза меньше тепла. Скрытая теплота испарения бериллия необычно высока (34,4 кДж/г), в несколько раз больше, чем у других металлов (в расчете на единицу массы). Удельная теплоемкость бериллия в 2,5 раза превышает теплоемкость алюминия и в 8 раз больше, чем у стали. По электро- и теплопроводности бериллий уступает лишь серебру, меди, золоту и алюминию. У бериллия самая высокая среди всех элементов (за исключением углерода) температура Дебая (1463 К). Коэффициент линейного расширения бериллия примерно такой же, как у железа.
При комнатной температуре бериллий устойчив в сухой атмосфере, но во влажном воздухе медленно окисляется. При нагреве в воздушной атмосфере до температур примерно 600 ºС окисление бериллия незначительно. Металлический бериллий непосредственно реагирует с азотом при температурах выше 700 ºС с образованием нитрида Be3N2, отличающегося высокой твердостью.
Бериллий не вытесняет водород из воды, так как на его поверхности образуется плотная оксидная пленка. В перегретой воде при 300 ºС технический бериллий разрушается через двое суток. Бериллий стоек в расплавах лития до 593 ºС, в ртути – до 315 ºС, в висмуте и свинце – до 673 ºС. Натрий, калий и кальций технической чистоты вызывают коррозию бериллия из-за его взаимодействия с кислородом, растворенным в этих металлах. Если содержание кислорода в расплавах щелочных металлов меньше 0,01 %, то коррозии не происходит.
Сырье для производства бериллия
По распространенности бериллий занимает 32-е место среди других элементов; его содержание в земной коре составляет 6·10-4 %. Он встречается в виде собственных минералов или входит в состав других минералов в качестве изоморфной примеси. Известно 54 собственно бериллиевых минерала, большая часть которых мало изучена. Преобладающее значение имеют силикаты; известны фосфаты, оксиды, антимонаты, бораты, арсенаты и карбонаты.
В настоящее время за рубежом используются два промышленных минерала: берилл и бертрандит.
Берилл Be3Al2 [Si6O18] – силикат кольцевой структуры, содержит 10,5–14,3 % BeO. Обычные примеси – щелочные элементы Li, Na, R, Rb, Cs; меньшее значение имеют Mg, Mn, Fe, Cr, H2O. Чистый берилл бесцветен; окраска его обусловлена примесями, главным образом железом и хромом. Окрашенные и хорошо закристаллизованные разновидности берилла используют как драгоценные камни: изумруд – зеленый, аквамарин – зеленовато-голубой, воробьевит (содержит до 3 % Cs2O) – розовый, гелиодор – желтый.
Берилл встречается почти во всех минеральных образованиях, за исключением собственно магматических. Но для промышленного использования до последнего времени разрабатывали лишь месторождения крупнокристаллического берилла, связанные с гранитными магматитами, позволяющие применять ручную рудоразборку. Большая потребность в бериллии привела к совершенствованию методов обогащения и к использованию других типов месторождений, содержащих мелкокристаллический берилл, в частности комплексные сподумен-берилловые руды.
Интенсивные исследования, проводившиеся в последние годы во многих странах, привели к открытию новых промышленных типов месторождений гидротермально-пневматолитического характера. Основные минералы этих месторождений – бертрандит, фенакит, хризоберилл, а в некоторых случаях вместе с ними присутствуют бехоит, гадолинит, гельвин и эвклаз.
Бертрандит Be4[Si2O7](OH)2 – минерал бесцветный, иногда бледно-желтый, содержит 39,6–42,6 % BeO; в качестве примесей иногда присутствуют Al3+ и Fe3+ . Кристаллизация его происходит в широком диапазоне условий минералообразования, но при явно выраженном дефиците алюминия.
Фенакит Be2[SiO4] – островной силикат, содержит 45,5 % BeO. Обычно бесцветен, но иногда окрашен примесями в винно-желтый или розовый цвет. Генетически родствен бертрандиту. В ближайшей перспективе планируется освоение его месторождений.
Хризоберилл Al2BeO2 содержит 18,1–20,7 % BeO. Окрашен в цвета от зеленого и зеленовато-желтого до буровато-желтого. Изумрудно-зеленая драгоценная разновидность хризоберилла известна под названием александрита. Окраска александрита вызвана примесью Cr3+. Образование хризоберилла связано с пегматитовым и гидротермально-пневматолитическим процессами в условиях большого дефицита SiO2. Содержание BeO в разрабатываемых рудах – от 0,02 до 0,6 %.
В большинстве пегматитовых месторождений берилл входит в состав комплексных руд наряду с другими редкометальными минералами, бертрандитовые месторождения относятся к монометальным. Подтвержденные запасы бериллия более 1100 тыс. т BeO. Около 80 % запасов сосредоточено в четырех странах: Бразилии (380 тыс. т), Индии (180 тыс. т), Аргентине (70 тыс. т) и США (55 тыс. т).
Бериллиевые руды относятся к труднообогатимым вследствие близости свойств минералов бериллия и пустой породы.
Основные методы обогащения бериллиевых руд следующие:
Ручная рудоразборка. Применяют для крупнокристаллических берилловых руд (минимальный размер кристаллов должен быть ∼ 10 мм) пегматитовых месторождений, что дает возможность извлекать лишь 30 % содержащегося в руде бериллия. Разработаны методы автоматизированной радиометрической рудоразборки по наведенной радиоактивности при облучении γ-лучами.
Избирательное измельчение применяют для руд, содержащих мягкие породы (слюдистые сланцы, тальк). Твердые минералы бериллия отделяют на грохотах или классификаторах от минералов пустой породы.
Флотация. Применяют для руд с мелкой вкрапленностью берилла. При обогащении сподумен-берилловых руд вначале производят флотацию сподумена. Ее хвосты, представляющие собой черновой берилловый концентрат, флотируют затем по кислотной или щелочной схеме. Флотационные методы дают возможность извлечь ∼ 85 % берилла. При флотационном обогащении пегматитов, содержащих менее 0,1 % BeO, удалось получить концентраты с 8–11,5 % BeO с 70–80 %-ным извлечением.
Способы получения бериллия
Металлотермические методы
Эти методы были испробованы по отношению к оксиду и галогенидам бериллия. Для восстановления оксида бериллия из обычно применяемых металлов пригоден лишь Ca. Однако продукт восстановления загрязняется кальцием вследствие образования соединения CaBe13. Неудачна и попытка использовать для восстановления Ti и Zr. В данном случае реакция проходит в твердой фазе (температуры плавления компонентов очень высоки), поэтому выход во многом зависит от степени контактирования BeO с восстановителем, в связи с чем брикетирование производили под давлением 101 МПа. Этот процесс, проводившийся в глубоком вакууме (133 Па) и при 1785 ºС, оказался слишком дорогим, чтобы получить широкое применение.
Для восстановления фторида и хлорида бериллия применимы все обычные металлы-восстановители. Из упомянутых галогенидов менее пригоден BeCl2 . Его труднее обезводить, процесс восстановления можно проводить лишь ниже 550 ºС (температура кипения BeCl2). Это намного ниже температуры плавления металла, поэтому бериллий получается в виде тонкого порошка, который легко окисляется при выгрузке и с трудом отделяется от шлака.
Фторид бериллия (Ткип =1327 ºС) позволяет вести процесс с получением расплавленного бериллия, образующего корольки металла. Из восстановителей наиболее подходит магний, так как щелочные металлы, например Na, обладают низкой температурой кипения, кроме того, в процессе восстановления образуется соединение NaF · BeF2, которое далее не восстанавливается натрием, что существенно снижает выход бериллия.
Магнийтермическое восстановление фторида бериллия
Это самый распространенный метод получения металлического бериллия. Реакция восстановления фторида бериллия магнием протекает быстро уже при температуре около 900 ºС, однако для разделения продуктов реакции они должны быть нагреты до 1300 ºС, т. е. выше температур плавления бериллия и фторида магния. В процессе восстановления выделяется большое количество тепла, которое идет на испарение магния, что создает возможность выброса материала из зоны реакции. Указанные осложнения устраняют добавлением флюсов, на плавление которых это тепло и расходуется. Наиболее целесообразным оказалось использовать в качестве флюса избыток BeF2, что исключает загрязнение металла посторонними добавками. Система MgF2 – BeF2 позволяет выбрать наиболее рациональный состав шлака. Хорошие результаты могут быть достигнуты при введении магния в количестве не более 75 % от стехиометрически необходимого. При таком соотношении бериллий легко отделяется от шлака за счет растворения с поверхности частичек восстановленного металла оксидной пленки, мешающей их слиянию. Плотность шлака больше плотности бериллия, поэтому последний всплывает на поверхность ванны.
Восстановление ведут в графитовых тиглях, нагреваемых в индукционных печах. Расплавленный бериллий накапливается на поверхности шлака. При охлаждении тигля металл кристаллизуется раньше шлака, что позволяет извлекать слиток бериллия из расплава солей. Шлак в расплавленном состоянии сливают из тигля в графитовую изложницу. Соли с поверхности слитка бериллия растворяют в воде. Фторид бериллия извлекают из шлака в процессе выщелачивания раствором фторида аммония. Получаемый раствор поступает на стадию производства фторида бериллия. Нерастворимый осадок, состоящий из фторида магния, после переработки используют в качестве флюса в процессе восстановления. Частицы и куски восстановленного металла содержат 97 % Be, а также некоторое количество шлака и непрореагировавшего магния. Суммарное извлечение бериллия в процессе восстановления 96 %, продолжительность цикла 3,5 ч.
Электролитическое производство бериллия
Бериллий не может быть получен электролизом водных растворов его солей, так как имеет высокий отрицательный электродный потенциал, поэтому при электролизе на катоде выделяется водород. Электролитическое производство можно осуществить, используя расплавы солей, в частности расплавы галогенидов бериллия. Однако их расплавы не проводят ток, поэтому электролиз возможен лишь в присутствии второго компонента, обладающего достаточной электропроводностью и более высоким по сравнению с галогенидами бериллия напряжением разложения. Этими свойствами обладают галогениды щелочных металлов.
Соответствующий состав электролита в принципе допускает использование и хлоридной, и фторидной ванн. Но высокая температура плавления BeF2 (800 ºС) обусловливает проведение высокотемпературного процесса. Это влечет за собой конструктивные затруднения и способствует окислению выделяющегося металла. Предпочитают низкотемпературный электролиз из ванны, содержащей хлориды бериллия и натрия. Оптимальный состав электролита был найден в результате изучения плавкости в системе BeCl2 – NaCl. В системе обнаружены низкотемпературная эвтектика (215 ºС), содержащая 50 % (мол.) BeCl2, и инконгруэнтно плавящееся соединение Na2BeCl4. В этом соединении бериллий координационно связан с хлором, но связь неустойчива.
Электролиз проводят в сварных никелевых ваннах, снабженных электрическим нагревателем. Анод изготовляют из плотного графита, что снижает выкрашивание анода с поверхности и тем самым уменьшает возможность загрязнения электролита. Катодом служит сама никелевая ванна. В этом случае по окончании электролиза электролит перекачивают в другую ванну, а металл вычерпывают перфорированным ковшом. На некоторых предприятиях применяют съемные катоды в виде перфорированных никелевых ящиков, вставляемых в ванны. Ванну и катод перед электролизом бериллируют для уменьшения загрязнения никелем.
Электролитический бериллий чище металлотермического. Это объясняется тем, что и электролиз, и предшествующее ему хлорирование BeO – рафинирующие операции. Указанное преимущество делает электролитический метод конкурентоспособным, несмотря на значительно меньший выход металла.
Сплавы на основе бериллия
Подавляющее большинство элементов периодической системы обладают ничтожной растворимостью в бериллии или практически не растворяются в нем. Заметной растворимостью в твердом бериллии при высоких температурах обладают такие элементы, как Co, Ni, Cu, Au, Pd. Однако растворимость этих металлов в бериллии с понижением температуры сильно уменьшается, и появляются выделения вторых фаз, вызывающие охрупчивание бериллия.
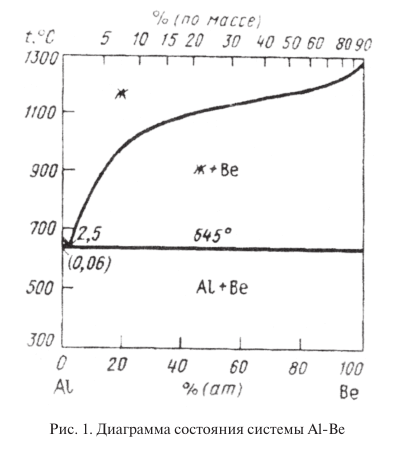
Большой интерес представляют сплавы бериллия с 20…40 % алюминия. Эти сплавы отличаются высокими механическими и технологическими свойствами при плотности не намного большей, чем у бериллия. Они обрабатываются значительно легче, чем чистый бериллий. Бериллий образует с алюминием диаграмму состояния эвтектического типа практически без взаимной растворимости (рис. 1). Структура сплавов бериллия с 20…40 % Al представлена хрупкими сравнительно твердыми частицами бериллия и мягкой высокопластичной алюминиевой фазой. Алюминиевая фаза и придает сплавам достаточно высокую технологичность и пластичность. Хотя алюминий и снижает модули упругости бериллия, они остаются достаточно высокими и составляют 220000…250000 МПа при 25…30 % Al, в связи с чем эти сплавы по удельному модулю упругости превосходят все конструкционные материалы. Перспективный для промышленного применения сплав Be + 38 % Al имеет σ в = 385 МПа; σ 0,2 = 300 МПа; δ = 7 %; Е = 189000 МПа. Механические свойства сплавов системы Be – Al могут быть существенно повышены легированием магнием и цинком.
В связи с открытием у бериллия полиморфизма были приняты попытки стабилизировать β-фазу при комнатной температуре. Бериллиевые сплавы со стабилизированной β-фазой благодаря ее кубической структуре должны обладать значительно большей пластичностью по сравнению с α-бериллием и сплавами на основе α-фазы. Фаза β закалкой в воде в бериллиевых сплавах не фиксируется. В системах бериллия с никелем и кобальтом β-фазу удалось зафиксировать лишь сверхбыстрой закалкой при скоростях охлаждения порядка 10 6 град/с. Поэтому в настоящее время стабилизацию β-фазы для получения бериллиевых сплавов считают весьма проблематичной.

