Двухкомпонентная система – это специальный механизм, имеющий молекулярно-биологическую основу, с помощью которого клетки могут ощущать и реагировать на любые изменения факторов окружающей среды. Он есть у бактерий, и представляет собой набор из нескольких десятков датчиков, которые исследуют местные условия, и решают, как на них лучше реагировать.
Данную систему и принцип ее функционирования изучали на протяжении многих лет. Было выяснено, что этот механизм имеет определенные закономерности и работает по правилам. Их описал Уиллард Гиббс – американский физик и математик.
Как звучит правило Гиббса?

Правило фаз Гиббса для двухкомпонентной системы обеспечивает теоретическую основу, основанную на термодинамике, для характеристики химического состояния и предсказания равновесных соотношений фаз (минералов, расплавов, сплавов, жидкостей, паров), присутствующих в зависимости от физических условий, таких как давление и температура.
Системы, которые находятся в термодинамическом равновесии, обычно считаются изолированными от окружающей среды в каком-то закрытом контейнере, но можно считать, что многие геологические структуры подчиняются правилу фаз. Кроме этого, в двухкомпонентных системах можно добиться равновесия жидкости и пара, то есть абсолютно противоположных состояний.
Гиббс выразил все это в простой формулировке:
P + F = C + 2,
где:
- P – это количество фаз. Уникальными считаются магматические расплавы, жидкости (водные растворы) и пар. Но стоит заметить, что наличие двух или более фаз в одном и том же состоянии вещества вполне возможно. Например, скопление твердых минералов, несмешивающиеся жидкости, такие, в которых есть следующие компоненты: вода и углероды;
- F – количество степеней свободы;
- C – минимальное количество химических компонентов, необходимых для образования всех фаз.
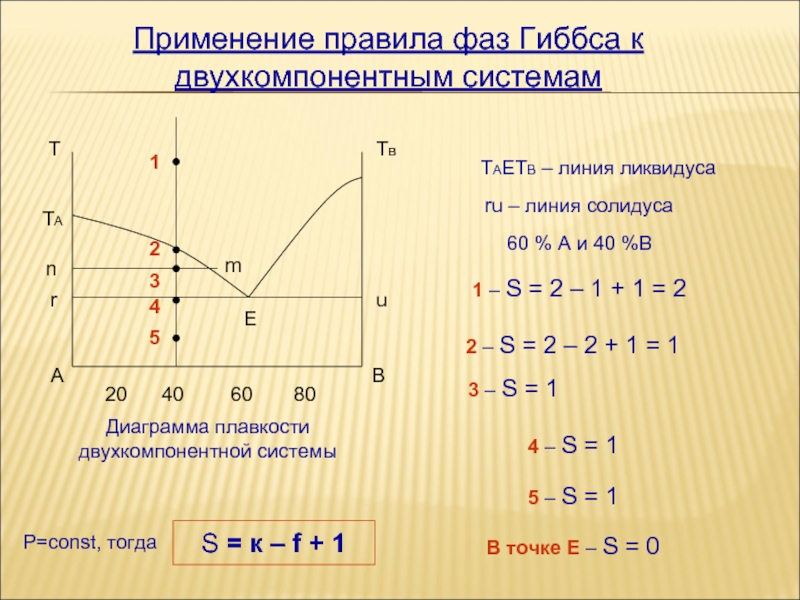
Равновесие в двухкомпонентных системах
Фазовое равновесие в двухкомпонентных системах предусматривает собой наличие одной или нескольких фаз, каждая из которых содержит один или более видов. При этом интенсивные свойства будут иметь определенные значения. Таким образом, система будет оставаться в равновесии, если будет изменяться количество фаз без изменения их температуры, давления или состава.
Равновесие представляет собой точку тепловой, механической и переносной устойчивости при изменении концентрации интенсивных переменных. Например, повышение или понижение температуры, увеличение давления.
Применение правила
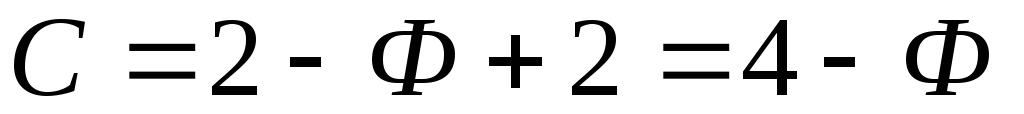
Зная принципы и условия равновесия между фазами и использовав правила Гиббса, можно узнать характеристики химического состояния и предсказать равновесное соотношение фаз (минералов, расплавов, жидкостей, паров), которые присутствуют в зависимости от физических условий, таких как давление и температура. Кроме этого, можно предсказать поведение вещества или смеси при различных переменных.
Чаще всего правило применяется в таких областях, как металлургия, химические технологии, медицина, строительство, материаловедение. Его используют специалисты на предприятиях разных размеров, а также для всевозможных целей.