Одна из первых диаграмм состояния системы Mn — N, построенная М. Хансеном и К. Андерко по результатам исследований 30—40-х годов, представлена на рис. 16.1. Азот образует твердые растворы в каждой аллотропной модификации марганца, хотя растворимость его в этих формах марганца различная. На диаграмме наибольшую концентрационную область занимают растворы на основе γ-Mn. Поля существования твердых растворов на основе других модификаций существенно меньше. Полагают, что азот, растворяясь в γ-Mn, повышает температуру плавления марганца примерно до 1300 °С. По достижении этой температуры γ-твердый раствор выделяет азот и, как следует из приведенной диаграммы, температура плавления резко снижается.
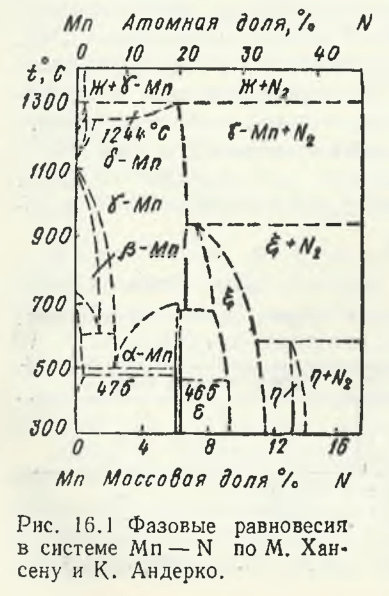
Наряду с областями существования твердых растворов азота во всех аллотропных модификациях марганца, на представленной диаграмме рис. 16.1 представили существование трех нитридных фаз: ε-, ξ- и η-фазы, которым исследователи приписывают различные формулы нитридов, ε-фаза (Mn4N) имеет узкую область гомогенности (от 20,0 до 21,4 % (мол.) N). Границы существования ξ-фазы (Mn5N2 + MnN) перемещаются со стороны марганца от 28 % (мол.) при 540 °С до 24,7 % (мол.) N при 750 °С, что ранее принималось как непрерывный переход от ГЦК-решетки ε-фазы к гексагональной решетке ξ-фазы. По оценке авторов, кристаллохимическое превращение ε-фаза → ξ-фаза маловероятно, поэтому на рис. 16.1 представлены две фазовые области. Первоначально ξ-фазе был приписан состав Mn5N2 (9,25 % (мас.) N) с широкой областью гомогенности. При 400 °С минимальное содержание азота составляет 28,4 % (мол.) N (9,2 % (мас.), N), а максимальное — 34,6 % (мол.) N (11,9 % (мае.) N). Полагают, что ξ-фаза включает составы Mn5N2 и Mn2N. Область ξ-фазы выклинивается при 940 °С. Существованию η-фазы на диаграмме (рис. 16.1) отведен интервал концентрации азота от 38,0 до 39,0 % (мол.) N (13,5—14 % (мас.) N). Это наиболее богатая азотом нитридная фаза марганца и вместе с тем термически наименее устойчивая. При температурах >580 °С η-фаза диспропорциируег на ξ-фазу и молекулярный азот.
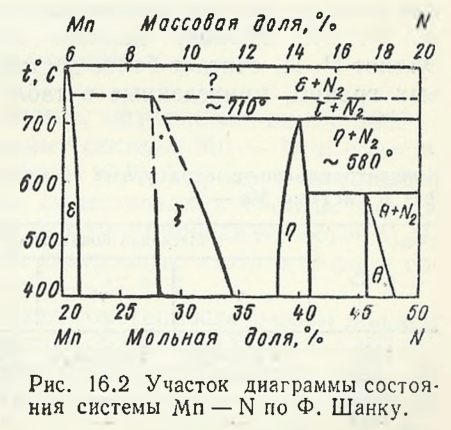
После 40-х годов вплоть до настоящего времени диаграмма состояния Mn — N и вопросы уточнения ее фазового состава и температурно-концентрационных областей существования последних постоянно находились в поле зрения исследователей. Это объясняется необходимостью накопления новых научных знаний о взаимодействии в системе Mn — N и широким использованием их для создания новых и совершенствования действующих процессов получения азотированного марганца, азотсодержащих хромомарганцевых сталей и др. В справочнике Р. П. Эллиота, вышедшего несколько позже справочника, обобщены результаты новых исследований изучения фазовых равновесий в системе Mn — N. Существенным элементом новизны, отмеченным Р. П. Эллиотом, является указание на неправильное оконтуривание области твердого раствора на основе γ-Mn. При 800 °С по Р. П. Эллиоту должна существовать двухфазная область. Эллиот Р. П. считает более достоверными данные о положении фазовых границ, приведенные в табл. 16.1.

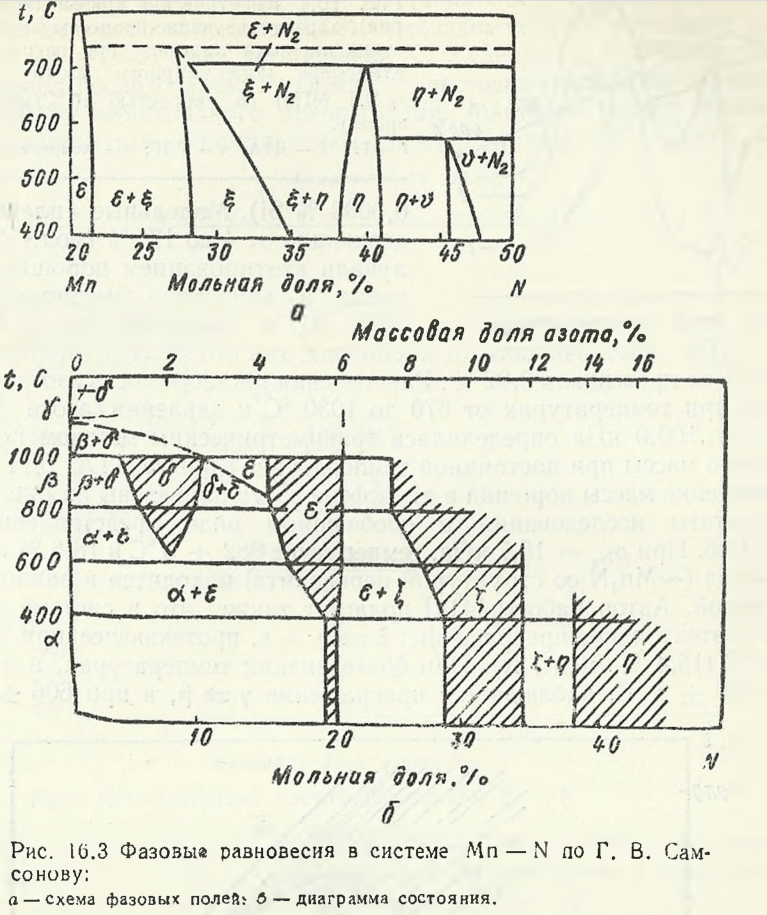
Шанк Ф., обобщив новые данные, опубликованные в 1962 — 1964 гг., представил частную диаграмму системы Mn — N в области концентраций от 20 до 50 % (мол.) N (рис. 16.2). Наряду с известными ε1— , ε- и η-фазами нанесена область существования θ-фазы. Самсонов Г. В. θ-фазу обозначил как ν-фaзy, приписав ей состав Mn6N5 (рис. 16.3). При 400 °С минимальное содержание азота в θ-фазы составляет 45,7 % (мол.) и максимальное — 47,9 %.
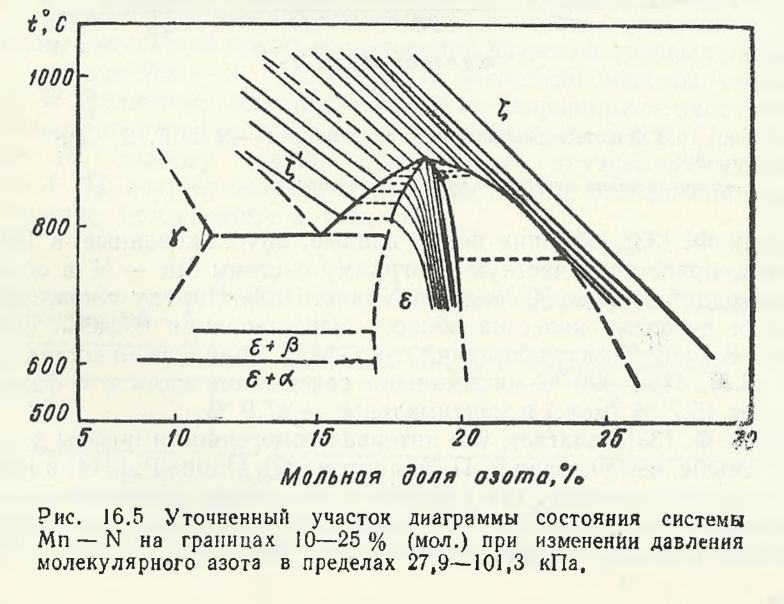
Шанк Ф. полагает, что интервал гомогенности η-фазы должен быть меньше, чем указано Р. П. Эллиотом. Помпе Р. в 1979 г. выполнил исследования для уточнения диаграммы состояния Mn — N в границах 10—25 % (мол.) N. В экспериментах использован порошок марганца высокой чистоты (99,9 % Mn; Mg 0,004; 0,0005 % Fe; 0,0002 % Si). Модельные сплавы, содержащие от 4 до 17 % (мол.) N, получали азотированием порошка марганца в атмосфере молекулярного азота при температурах до 1050 °С и давлении pN2 = 27,9…101,3 кПа. Азот очищали от кислорода, так что массовая концентрация его не превышала 0,02 %. Равновесная растворимость азота в марганце при температурах от 670 до 1030 °С и давлении азота pN2 = 0,46… 100,0 кПа определялась гравиметрическим методом по увеличению массы при постоянной температуре. Кривые ДТА, ДТГ и ТГ и изменение массы порошка в атмосфере азота приведены на рис. 16.4. Результаты исследования в обобщенном виде представлены на рис. 16.5.

При pN2 = 15,7 кПа, температуре 882 ± 3 °С и 18,6 % (мол.) N ε-фаза (~Mn4N со структурой перовскита) находится в равновесии с ξ-фазой. Автор работы полагает также, что в системе имеет место эвтектоидное превращение: ξ ⇔ γ + ε, протекающее при 782 ± 3 °С (15,4 % (мол.) N). При более низких температурах, а точнее при 640 ± 5 °С, наблюдается превращение γ ⇔ β, а при 606 ± 3 °С имеет место превращение β ⇔ φ. Нестабильность ξ-фазы при <800 °С и массовом содержании азота 13 % с распадом ее по эвтектоидной реакции на γ и ε-фазы была установлена X. Куделька и X. Грабке. Благодаря исследованию Р. Помпе, существенно уточнены параметры указанного эвтектоидного превращения. Марганец может образовывать с азотом также комплексные азиды, например Mn (N3)4OR. Как известно, азиды представляют соединения, содержащие одну или несколько групп — N3 . Азиды металлов неустойчивы и при трении, ударе, действии света разлагаются со взрывом.
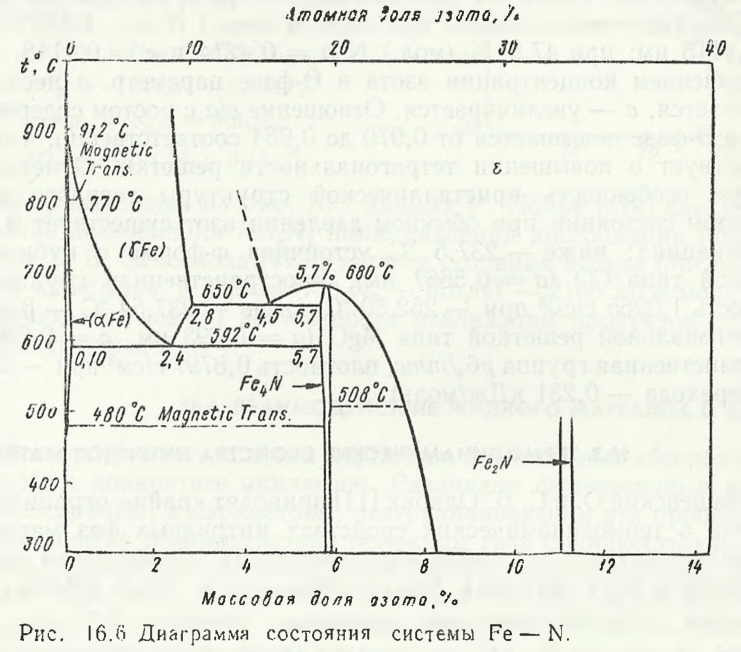
При азотировании ферромарганца азот взаимодействует наряду с марганцем также и с атомами железа. В бинарной системе Fe — N (рис. 16.6) образуются нитриды Fe4N и Fe2N, а также твердые растворы на основе в основном γ-Fe. Поскольку концентрация железа в марганцевых ферросплавах невелика (до 15 %) следует полагать, что нитридные фазы в системе Mn— Fe — N формируются на основе марганца.
Взаимодействие жидкого марганца с азотом
Поглощение азота жидким марганцем представляет абсорбционный процесс, а конкретнее окклюзию. Различают физическую и химическую абсорбцию, а параметром, разграничивающим эти процессы, является энергия взаимодействия молекулы газа с жидкостью и, по-видимому, с расплавом металла. Если энергия взаимодействия молекулы ≤20 кДж/моль, то такой процесс относят к физической абсорбции, если >25 кДж/моль — к химической абсорбции. Процессы, сопровождающиеся изменением энергии в пределах 20—25 кДж/моль, рассматривают как промежуточные.
В известных работах вопросы термодинамики взаимодействия марганца с азотом ограничены анализом термодинамических функций применительно к твердым нитридным фазам. Термодинамика и кинетика абсорбционных процессов в системе чистый жидкий марганец — молекулярный азот рассмотрены в единичных исследованиях. Как правило, в ранних исследованиях (от первых работ И. И. Жукова (1908 г.) и (1926 г.) и включая экспериментальные исследования, выполненные в 50—60-х годах) задача сводилась к установлению экспериментальной зависимости растворимости молекулярного азота в жидком марганце от температуры и давления, поскольку из-за различной чистоты использовавшегося в опытах марганца и методик экспериментов количественные соотношения [N]Mn (T, p), полученные различными авторами, существенно различаются.
Экспериментальные исследования растворимости азота в чистом жидком марганце предпринимались с конца XIX в. Известны работы в этой области И. И. Жукова (1908г.), Н. Э. Гокен экспериментально определил функцию[N]Mn (Т), которая имеет вид lg[N]Mn = 3090/Т — 1,55 [% (мол.)]; ΔGT = —53 989 + 27,08Т, Дж/моль. По данным И. Б. Бараташвили, растворимость молекулярного азота в жидком марганце [% (мол.)] при различной температуре и давлении pN2 = 0,1 МПа описывается выражениями
![]()
В. П. Перепелкин экспериментально установил, что растворимость азота в жидком марганце при давлении 101 кПа составляет 2,5 % при 1300 °С и уменьшается до 1,6 % при 1500 °С.
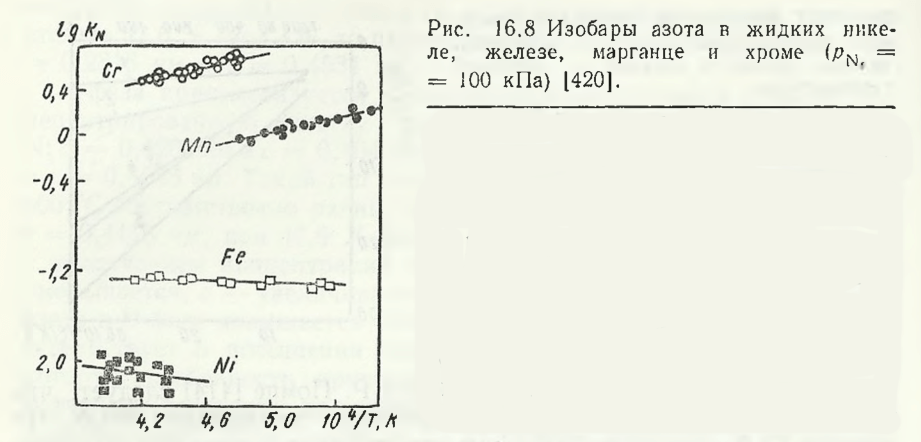
Григоренко Г. М. и Ю. М. Помарин обобщили результаты исследования растворимости азота в жидком марганце и некоторых других 3d-металлах (Cr, Fe, Ni). Температурные зависимости растворимости азота lg KN в расплавах этих металлов представлены на рис. 16.8, а термодинамические константы этого процесса при pN2 = 100 кПа — в табл. 16.2. Теплоты растворения азота в жидких марганце и хроме имеют положительное значение, а для железа и никеля — отрицательные.

В расплавах системы Mn — Fe растворимость азота при pN2 = 100 кПа растет с повышением концентрации марганца, а энтальпия растворения в интервале 3—8 % Mn изменяет знак (с плюса на минус) (табл. 16.3).
Экспериментальные данные температурной зависимости растворимости азота во всем интервале составов расплавов системы марганец — железо описывается выражением
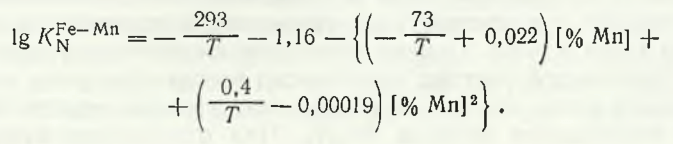
Бурылев Б. П. предложил для расчета растворимости азота в расплавах системы Mn — Fe выражение
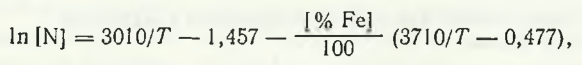
где [% Fe]— массовая концентрация железа в расплаве Mn — Fe. Расчет по этой формуле для сплава 80 % Mn — 20 % Fe при 1500 °С дает значение растворимости, равное ~0,8 % N.

