Первые опыты по получению марганца электролизом за рубежом были проведены Р. Бунзеном в 1854 г. В России известный электрохимик П. П. Федотьев исследовал процес выделения марганца электролизом из растворов хлорида и сульфида марганца. В СССР первая промышленная установка для получения марганца электролизом была сооружена в Закавказье в 1942 г. на основании опытных работ под руководством академика АН ГрССР Р. И. Агладзе, и в настоящее время металлический марганец электролизом сернокислых растворов марганца производится на ЗЗФ. В Великобритании разработки по электролизу растворов марганца, химии и алюминотермии марганца были начаты в 1940 г.
Мелкомасштабное (~15 кг Mn/сут) коммерческое производство электролитического марганца в Японии было организовано на заводе «Taguchi» в 1940 г. Постоянно растущая потребность в электролитическом марганце для выплавки сталей ряда марок, а также сплавов черных и цветных металлов обусловила высокие темпы развития его производства в 50—70-х годах. К началу 80-х годов объем выпуска электролитического марганца составил ~80 тыс. т/год.
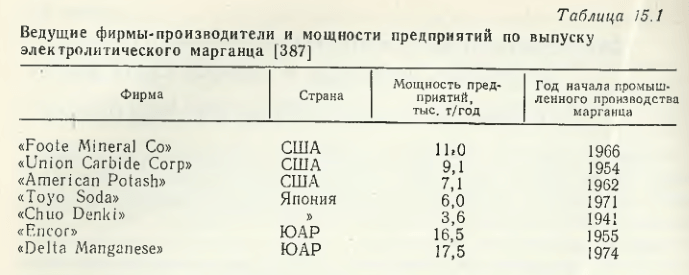
За рубежом основы процесса электролитического марганца разрабатывались фирмой «US Bureau of Mines» (США) в 1935 г. Начало промышленного производства фирмой «Electro Manganese Соrp» на основе этих разработок относится к 1939 г. Таким образом, разработка теоретических и технологических основ процесса электролитического выделения марганца из растворов (расплавов солей), как и промышленное освоение его производства в СССР и за рубежом, шли параллельно в 30—40-х годах. Научные разработки по совершенствованию технологии выделения марганца и повышения его качества продолжают интенсивно вестись в настоящее время. Наиболее крупные производители электролитического марганца и объемы его производства приведены в табл. 15.1.
Технологическая схема получения электролитического марганца на предприятиях, перечисленных в табл. 15.1 фирм, включает четыре основные стадии:
- термическую подготовку марганцевой руды (концентрата) к выщелачиванию путем измельчения ее и последующего восстановительного обжига с целью перевода высших кислородных соединений марганца в низшие; оксиды железа при этом переходят в Fe3O4, который в отличие от FeO менее растворим в разбавленной H2SO4;
- выщелачивание обожженной марганцевой руды (концентрата) в отработанном в электролизере с соблюдением режимов, обеспечивающих минимальный переход железа в раствор;
- очистку раствора перед электролизом от железа и цветных металлов (Ni, Co и др.) осаждением соединений этих металлов путем добавления в раствор сульфата аммония (NH4)2SO4;
- электролиз при 38 °С и плотности тока 4,3-5,4 А/дм2 в течение ∼32 ч. В качестве примера на рис. 15.1 приведена технологическая схема получения электролитического марганца по данным Р. Дуррера и Г. Фолькерта.
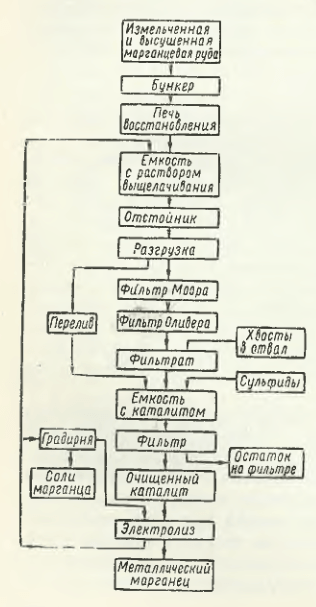
получения электролитического марганца.
Производимый за рубежом электролитический марганец подразделяется на различные сорта в зависимости от его назначения. Выпускают марганец в виде хлопьев (1,7—2 мм) с низким содержанием водорода и кислорода (<0,1 %). Фирмы поставляют также хлопьевидный азотированный марганец с 4—6 % N2. Наряду с хлопьевидным производят электролитический марганец в виде гранул менее 6—8 меш и <10 меш (ASTM) и порошка различной степени дисперсности (<20; <30; <40; <60; <80; <325 меш (ASTM).
Электрохимические эквиваленты и стандартные электродные потенциалы марганца
Электрохимические эквиваленты марганца q [r/(А • ч)] следующие: Mn2+ + 2e → Mn, qMn3+ = 1,0245; Mn4+ + 4e → Mn, qMn4+ = 0,5122; Mn5+ + 5e → Mn, qMn5+ = 0,509; Mn7+ + 7e → Mn, qMn7+ = 0,273.
Кристаллохимические радиусы катионов марганца с повышением степени окисленности уменьшаются и имеют следующие значения: rMn2+ = 0,091 нм; rMn4+ = 0,052 нм; rMn6+ = 0,030 нм. Для сравнения отметим, что rFe2+ = 0,083 нм; rCO2+ = 0,072 нм и rNi2+ = 0,078 нм. Кристаллохимический радиус анионов rSO4-4 = 0,295 нм; rCO2-3 = 0,265 нм; rPO4-4 = 0,030 нм; rSiO4-4 = 0,290 нм. Баймаков Ю. В. и А. И. Журин для приведенных ниже девяти обратимых восстановительно-окислительных реакций дают следующие значения стандартных потенциалов (φ0, В):
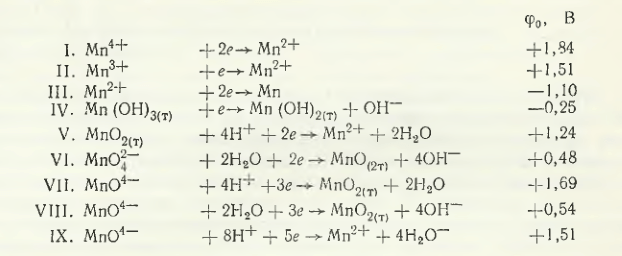
Из этих данных следует, что на катоде в первую очередь создаются условия для восстановления катионов марганца высшей валентности до низшей и в конечном итоге до осаждения марганца (реакции I—III). В щелочных средах с применением нерастворимого анода на нем возможна в первую очередь реакция IV (φ0 = —0,25 В), а в нейтральных и кислых растворах — реакция V (φ0 = 124 В). Реакции V, VII и VIII сопровождаются потребителем ионов H+, а реакции IV, VI и VIII — ионов ОН—. По Ю. В. Баймакову и А. И. Журину, при наличии в нейтральных растворах ионов высших валентностей на катоде неизбежно образуются основные соли. По этой причине при электролизе раствора марганца (pH ≥ 7) не следует допускать в катодное пространство ионы высшей валентности. Ионы Mn2+ разряжаются, как следует из приведенных выше реакций, при электроотрицательном потенциале (φ0 = —1,10 В) и только из растворов с низкой концентрацией ионов водорода (pH ≥ 7,0). Вместе с тем па катоде одновременно восстанавливаются ионы марганца и водорода и на катоде, по мнению Ю. В. Баймакова и А. И. Журина, наблюдается высокое перенапряжение водорода. В связи с этим соли аммония влияют на процесс разряда марганца. Вследствие образования двойной соли (NH4)2Mn(SO4)2 значение pH образования Mn(ОН)2 сдвигается до 9. Это снижает концентрацию ионов водорода и сдвигает потенциал разряда его ионов в электроотрицательную сторону.
Влияние примесей в электролите (Fe, Ni, Co, Cu и др.) авторы объясняют тем, что перенапряжение водорода на них незначительно, поэтому даже малые их количества в растворе (электролите) увеличивают скорость разряда ионов водорода, что сопровождается попаданием этих солей в катодный марганец и падением выхода по току. Так, например, содержание 0,005 г Co/л и 0,004 г As/л снижает выход по току на 20 %. Если в растворе имеются ионы Fe3+, то возможна реакция окисления осажденного марганца: 2Fe3+ + Mn → Mn2+ + 2Fe2+, а присутствие иона H+ создает условия для реакции Mn + 2H+ → Mn2+ + H2.

